高考卷2理科综合适用于甘肃、青海、内蒙古、黑、吉林、辽宁、宁夏、新疆、陕西、重庆。这些地区的考生觉得考试难度怎么样?物理化学生物三门科目的难度和考试强度都是对考生一个很大的考验,慕羽茜2019年高考2卷的理科综合试题还未公布,伊顿教育网小编为各位考生整理了2018年卷2的理科综合试题内容和参考答案,后续将会更新2019年的试题内容。相关链接:2019年卷2理科综合试题及参考答案!
2018年高考新课标Ⅱ(理综)试卷
一、选择题
1,下列关于人体中蛋白质功能的叙述,错误的是( ) A. 浆细胞产生的抗体可结合相应的病毒抗原
B. 肌细胞中的某些蛋白质参与肌肉收缩的过程
C. 蛋白质结合Mg2+形成的血红蛋白参与O2运输
D. 细胞核中某些蛋白质是染色体的重要组成成分
2,下列有关物质跨膜运输的叙述,正确的是( ) A. 巨噬细胞摄入病原体的过程属于协助扩散
B. 固醇类激素进入靶细胞的过程属于主动运输
C. 神经细胞受到刺激时产生的Na+内流属于被动运输
D. 护肤品中的甘油进入皮肤细胞的过程属于主动运输
3,下列有关人体内激素的叙述,正确的是( ) A. 运动时,肾上腺素水平升高,可使心率加快,说明激素是高能化合物
B. 饥饿时,胰高血糖素水平升高,促进糖原分解,说明激素具有酶的催化活性
C. 进食后,胰岛素水平升高,其既可加速糖原合成,也可作为细胞的结构组分
D. 青春期,性激素水平升高,随体液到达靶细胞,与受体结合可促进机体发育
4,有些作物的种子入库前需要经过风干处理,与风干前相比,下列说法错误的是( ) A. 风干种子中有机物的消耗减慢
B. 风干种子上微生物不易生长繁殖
C. 风干种子中细胞呼吸作用的强度高
D. 风干种子中结合水与自由水的比值大
5,下列关于病毒的叙述,错误的是( ) A. 从烟草花叶病毒中可以提取到RNA
B. T2噬菌体可感染肺炎双球菌导致其裂解
C. HIV可引起人的获得性免疫缺陷综合征
D. 阻断病毒的传播可降低其所致疾病的发病率
6,在致癌因子的作用下,正常动物细胞可转变为癌细胞,有关癌细胞特点的叙述错误的是( ) A. 细胞中可能发生单一基因突变,细胞间黏着性增加
B. 细胞中可能发生多个基因突变,细胞的形态发生变化
C. 细胞中的染色体可能受到损伤,细胞的增殖失去控制
D. 细胞中遗传物质可能受到损伤,细胞表面的糖蛋白减少
7,化学与生活密切相关。下列说法错误的是( ) A. 碳酸钠可用于去除餐具的油污
B. 漂白粉可用于生活用水的消毒
C. 氢氧化铝可用于中和过多胃酸
D. 碳酸钡可用于胃肠X射线造影检查
8, 研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如下图所示)。下列叙述错误的是( )
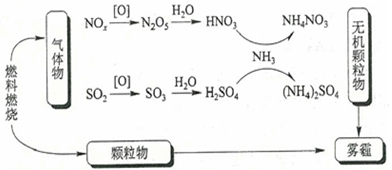
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
9, 实验室中用如图所示的装置进行甲烷与氯气在光照下反应的实验。
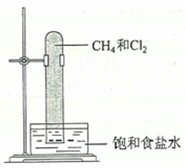
光照下反应一段时间后,下列装置示意图中能正确反映实验现象的是( )
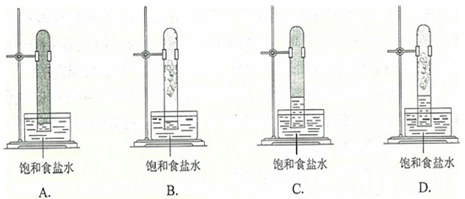
B. 如图所示B
C. 如图所示C
D. 如图所示D
10,W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子较外层的电子数与W的电子总数相同。下列叙述正确的是( ) A. X与其他三种元素均可形成两种或两种以上的二元化合物
B. Y与其他三种元素分别形成的化合物中只含有离子键
C. 四种元素的简单离子具有相同的电子层结构
D. W的氧化物对应的水化物均为强酸
11,NA代表阿伏加德罗常数的值。下列说法正确的是( ) A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol•L−1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
12, 我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na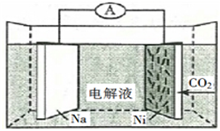
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e− =D. 充电时,正极反应为:Na++e−=Na
13, 下列实验过程可以达到实验目的的是( )
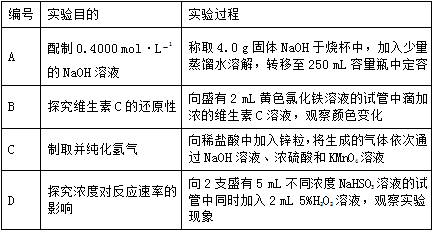
B. 如图所示B
C. 如图所示C
D. 如图所示D
二、选择题
14, 如图,某同学用绳子拉动木箱,使它从静止开始沿粗糙水平路面运动至具有某一速度,木箱获得的动能( )
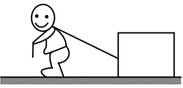
B. 等于拉力所做的功
C. 等于克服摩擦力所做的功
D. 大于克服摩擦力所做的功
15,高空坠物极易对行人造成伤害。若一个50g的鸡蛋从一居民楼的25层坠下,与地面的撞击时间约为2ms,则该鸡蛋对地面产生的冲击力约为( ) A. 10N
B. 102N
C. 103N
D. 104N
16,2018年2月,我国500m口径射电望远镜(天眼)发现毫秒脉冲星“J0318+0253”,其自转周期T=5.19ms,假设星体为质量均匀分布的球体,已知万有引力常量为6.67×10−11N⋅m2/kg26.67×10−11N⋅m2/kg2。以周期T稳定自转的星体的密度较小值约为( ) A. 5×109kg/m35×109kg/m3
B. 5×1012kg/m35×1012kg/m3
C. 5×1015kg/m35×1015kg/m3
D. 5×1018kg/m35×1018kg/m3
17,用波长为300nm的光照射锌板,电子逸出锌板表面的较大初动能为1.28××10-19J。已知普朗克常量为6.63××10-34J·s,真空中的光速为3.00××108m·s-1,能使锌产生光电效应的单色光的较低频率约为( ) A. 1××1014Hz
B. 8××1014Hz
C. 2××1015Hz
D. 8××1015Hz
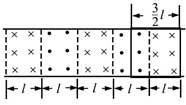
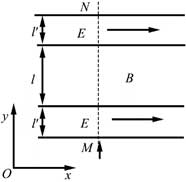
18, 如图,在同一平面内有两根平行长导轨,导轨间存在依次相邻的矩形匀强磁场区域,区域宽度均为l,磁感应强度大小相等、方向交替向上向下。一边长为32l32l的正方形金属线框在导轨上向左匀速运动,线框中感应电流i随时间t变化的正确图线可能是( )
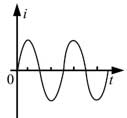
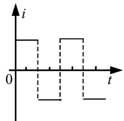
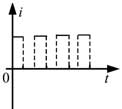
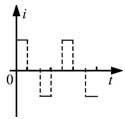
19, 甲、乙两汽车同一条平直公路上同向运动,其速度—时间图像分别如图中甲、乙两条曲线所示。已知两车在t2时刻并排行驶,下列说法正确的是( )
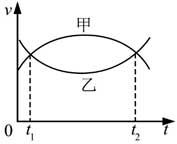
B. t1时刻甲车在后,乙车在前
C. 甲车的加速度大小先增大后减小
D. 乙车的加速度大小先减小后增大
20, 如图,纸面内有两条互相垂直的长直绝缘导线L1、L2,L1中的电流方向向左,L2中的电流方向向上;L1的正上方有a、b两点,它们相对于L2对称。整个系统处于匀强外磁场中,外磁场的磁感应强度大小为B0,方向垂直于纸面向外。已知a、b两点的磁感应强度大小分别为13B013B0和12B012B0,方向也垂直于纸面向外。则( )
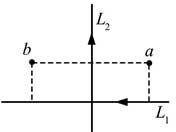
B. 流经L1的电流在a点产生的磁感应强度大小为112B0112B0
C. 流经L2的电流在b点产生的磁感应强度大小为112B0112B0
D. 流经L2的电流在a点产生的磁感应强度大小为712B0712B0
21, 如图,同一平面内的a、b、c、d四点处于匀强电场中,电场方向与此平面平行,M为a、c连线的中点,N为b、d连线的中点。一电荷量为q(q>0)的粒子从a点移动到b点,其电势能减小W1:若该粒子从c点移动到d点,其电势能减小W2,下列说法正确的是( )
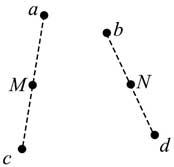
B. 若该粒子从M点移动到N点,则电场力做功为W1+W22W1+W22
C. 若c、d之间的距离为L,则该电场的场强大小为W2qLW2qL
D. 若W1=W2,则a、M两点之间的电势差等于b、N两点之间的电势差
三、非选择题(一)考试题
22, 某同学组装一个多用电表。可用的器材有:微安表头(量程100 μ A, μ A,内阻900ΩΩ);电阻箱R1(阻值范围0 ~ ~999.9ΩΩ);电阻箱R2(阻值范围0 ~ ~99 999.9ΩΩ);导线若干。
要求利用所给器材先组装一个量程为1mA的直流电流表,在此基础上再将它改装成量程为3V的直流电压表。组装好的多用电表有电流1mA和电压3V两挡。
回答下列问题:
(1)在虚线框内画出电路图并标出R1和R2,其中*为公共接线柱,a和b分别是电流挡和电压挡的接线柱______。
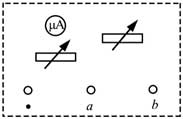
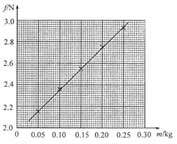
(2)电阻箱的阻值R1=R1=______ΩΩ;R2=______ΩΩ (保留到个位)23, 某同学用图(a)所示的装置测量木块与木板之间的摩擦因数。跨过光滑定滑轮的细线两端分别与木块和弹簧秤相连,滑轮和木块之间的细线保持水平,在木块上放置砝码。缓慢向左拉动水平放置的木板,当木块和砝码相对桌面静止且木板仍在继续滑动时,弹簧秤的示数即为木块受到的滑动摩擦力的大小。某次实验所得数据在下表中给出,其中f4f4的值从图(b)中弹簧秤的示数读出。
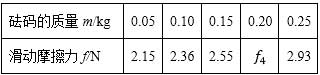
回答下列问题
(1)f4f4=______N
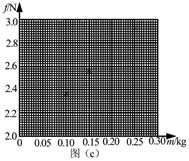
(2)在图(c)的坐标纸上补齐未画出的数据点______并绘出f-m图线______;
(3)f与m、木块质量M、木板和木块之间的滑动摩擦因数μμ及重力加速度大小g之间的关系式f=______,f-m图线(直线)的斜率的表达式k=____________;
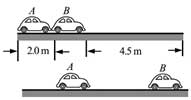
(4)取g=9.80 m/s2s2,由绘出的f-m图线求得μ=______(保留2位有效数字)24, 汽车A在水平冰雪路面上行驶,驾驶员发现其正前方停有汽车B,立即采取制动措施,但仍然撞上了汽车B。两车碰撞时和两车都完全停止后的位置如图所示,碰撞后B车向前滑动了4.5m,A车向前滑动了2.0m,已知A和B的质量分别为2.0×1032.0×103kg和1.5×1031.5×103kg,两车与该冰雪路面间的动摩擦因数均为0.10,两车碰撞时间极短,在碰撞后车轮均没有滚动,重力加速度大小g=10m/s2g=10m/s2.求
(1)碰撞后的瞬间B车速度的大小;
(2)碰撞前的瞬间A车速度的大小。
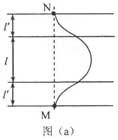
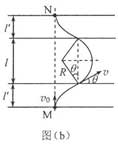
(1)定性画出该粒子在电磁场中运动的轨迹;
(2)求该粒子从M点射入时速度的大小;
(3)若该粒子进入磁场时的速度方向恰好与x轴正方向的夹角为π6π6,求该粒子的比荷及其从M点运动到N点的时间。
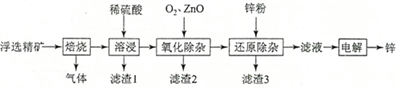
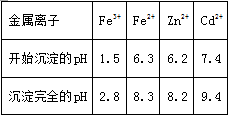
相关金属离子[c0(Mn+)=0.1 mol•L-1]形成氢氧化物沉淀的pH范围如下:
回答下列问题:
(1)焙烧过程中主要反应的化学方程式为______。
(2)滤渣1的主要成分除SiO2外还有______;氧化除杂工序中ZnO的作用是______,若不通入氧气,其后果是______。
(3)溶液中的Cd2+可用锌粉除去,还原除杂工序中反应的离子方程式为______。
(4)电解硫酸锌溶液制备单质锌时,阴极的电极反应式为______;沉积锌后的电解液可返回______工序继续使用。27, CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+CO2(g)=2CO(g)+2H2(g)。
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ•mol−1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ•mol−1
C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ•mol−1
该催化重整反应的ΔH==______ kJ•mol−1。有利于增强CH4平衡转化率的条件是______(填标号)。
A.高温低压
B.低温高压
C.高温高压
D.低温低压
某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2•L−2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。
相关数据如下表:
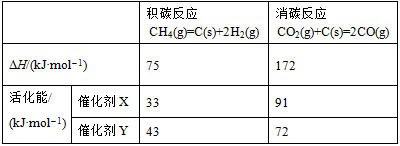
①由上表判断,催化剂X______Y(填“优于”或“劣于”),理由是______。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是______填标号)。
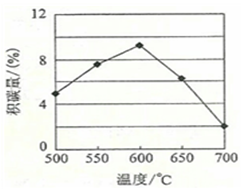
A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数大
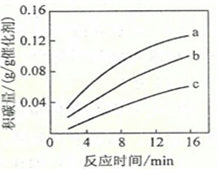
②在温度下,测得某催化剂上沉积碳的生成速率方程为v=k•p(CH4)•[p(CO2)]-0.5(k为速率常数)。在p(CH4)时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为______。
(2)某小组为探究三草酸合铁酸钾的热分解产物,按下图所示装置进行实验。
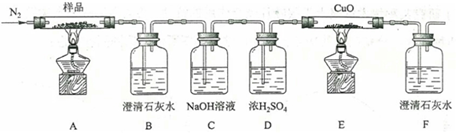
①通入氮气的目的是______。
②实验中观察到装置B、F中澄清石灰水均变浑浊,装置E中固体变为红色,由此判断热分解产物中含有______、______。
③为防止倒吸,停止实验时应进行的操作是______。
④样品完全分解后,装置A中的残留物含有FeO和Fe2O3,检验Fe2O3存在的方法是:______。
(3)测定三草酸合铁酸钾中铁的含量。
①称量m g样品于锥形瓶中,溶解后加稀H2SO4酸化,用c mol•L-1 KMnO4溶液滴定至终点。滴定终点的现象是______。
②向上述溶液中加入过量锌粉至反应完全后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用c mol•L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液V mL。该晶体中铁的质量分数的表达式为______。29, 为研究垂体对机体生长发育的作用,某同学用垂体切除法进行实验。在实验过程中,用幼龄大鼠为材料,以体重变化作为生长发育的检测指标。回答下列问题:
(1)请完善下面的实验步骤
①将若干只大鼠随机分为A、B两组后进行处理,A组(对照组)的处理是______,B组的处理是______。
②将上述两组大鼠置于相同的适宜条件下饲养。
③______。
④对所得数据进行统计处理与分析
(2)实验结果与分析
B组大鼠生长发育的状况不如A组,出现这种差异的原因是由于B组的处理使大鼠缺失了来源于垂体的______激素和______激素。30, 为了研究某种树木树冠上下层叶片光合作用的特性,某同学选取来自树冠不同层的A、B两种叶片,分别测定其净光合速率,结果如图所示。据图回答问题:
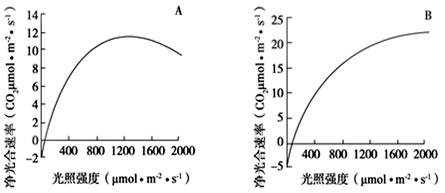
(1)从图可知,A叶片是树冠______(填“上层”或“下层”)的叶片,判断依据是______。
(2)光照强度达到数值时,A叶片的净光合速率开始下降,但测得放氧速率不变,则净光合速率降低的主要原因是光合作用的______反应受到抑制。
(3)若要比较A、B两种新鲜叶片中叶绿素的含量,在提取叶绿素的过程中,常用的有机溶剂是______。31, 大型肉食性动物对低营养级肉食性动物与植食性动物有捕食和驱赶作用。这一建立在“威慑”与“恐惧”基础上的种间关系会对群落或生态系统产生影响,此方面的研究属于“恐惧生态学”范畴。回答下列问题:
(1)当某种大型肉食性动物迁入到一个新的生态系统时,原有食物链的营养级有可能增加,生态系统中食物链的营养级数量一般不会太多,原因是______。
(2)如果将肉食性动物引入食物网只有三个营养级的某生态系统中,使得甲、乙两种植食性动物间的竞争结果发生了反转,即该生态系统中甲的数量优势地位丧失。假定该反转不是由于肉食性动物的直接捕食造成的,那么根据上述“恐惧生态学”知识推测,甲的数量优势地位丧失的可能原因是______(答出一点即可)。
(3)若某种大型肉食性动物在某地区的森林中重新出现,会减轻该地区野猪对农作物的破坏程度。根据上述“恐俱生态学”知识推测,产生这一结果的可能原因有______(答出两点即可)。32, 某种家禽的豁眼和正常眼是一对相对性状,豁眼雌禽产蛋能力强。已知这种家禽的性别决定方式与鸡相同,豁眼性状由Z染色体上的隐性基因a控制,且在W染色体上没有其等位基因。回答下列问题:
(1)用纯合体正常眼雄禽与豁眼雌禽杂交,杂交亲本的基因型为______。理论上F1个体的基因型和表现型为______, F2雌禽中豁眼禽所占的比例为______。
(2)为了给饲养场提供产蛋能力强的该种家禽,请确定一个合适的杂交组合,使其子代中雌禽均为豁眼,雄禽均为正常眼。写出杂交组合和预期结果,要求标明亲本和子代的表现型、基因型:______。
(3)假设M/m基因位于常染色体上,m基因纯合时可使部分应表现为豁眼的个体表现为正常眼,而MM和Mm对个体眼的表现型无影响。以此推测,在考虑M/m基因的情况下,若两只表现型均为正常眼的亲本交配,其子代中出现豁眼雄禽,则亲本雌禽的基因型为______,子代中豁眼雄禽可能的基因型包括______。(二)选考题
33,对于实际的气体,下列说法正确的是______。 A. 气体的内能包括气体分子的重力势能
B. 气体的内能包括分子之间相互作用的势能
C. 气体的内能包括气体整体运动的动能
D. 气体体积变化时,其内能可能不变
E. 气体的内能包括气体分子热运动的动能
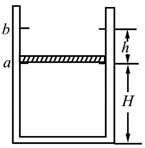
34, 如图,一竖直放置的气缸上端开口,气缸壁内有卡口a和b,a、b间距为h,a距缸底的高度为H;活塞只能在a、b间移动,其下方密封有质量的理想气体。已知活塞质量为m,面积为S,厚度可忽略;活塞和汽缸壁均绝热,不计他们之间的摩擦。开始时活塞处于静止状态,上、下方气体压强均为p0,温度均为T0。现用电热丝缓慢加热气缸中的气体,直至活塞刚好到达b处。求此时气缸内气体的温度以及在此过程中气体对外所做的功。重力加速度大小为g。
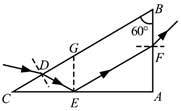
(i)求出射光相对于D点的入射光的偏角;
(ii)为实现上述光路,棱镜折射率的取值应在什么范围?37, 硫及其化合物有许多用途,相关物质的物理常数如下表所示:
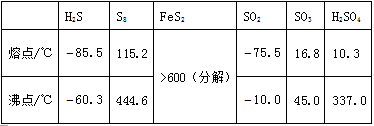
回答下列问题:
(1)基态Fe原子价层电子的电子排布图(轨道表达式)为______,基态S原子电子占据较高能级的电子云轮廓图为______形。
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是______。
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为______。
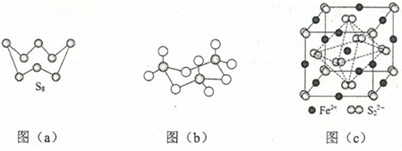
(4)气态三氧化硫以单分子形式存在,其分子的立体构型为______形,其中共价键的类型有______种;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为______。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为______g•cm−3;晶胞中Fe2+位于S2−2S22−所形成的正八面体的体心,该正八面体的边长为______nm。38, 以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:
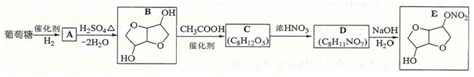
回答下列问题:
(1)葡萄糖的分子式为______。
(2)A中含有的官能团的名称为______。
(3)由B到C的反应类型为______。
(4)C的结构简式为______。
(5)由D到E的反应方程式为______。
(6)F是B的同分异构体,7.30 g的F与足量饱和碳酸氢钠反应可释放出2.24 L二氧化碳(标准状况),F的可能结构共有______种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为______。39, [生物——选修1:生物技术实践]
在生产、生活和科研实践中,经常通过消毒和灭菌来避免杂菌的污染。
回答下列问题:
(1)在实验室中,玻璃和金属材质的实验器具______(填“可以”或“不可以”)放入干热灭菌箱中进行干热灭菌。
(2)牛奶的消毒常采用巴氏消毒法或高温瞬时消毒法,与煮沸消毒法相比,这两种方法的优点是______。
(3)密闭空间内的空气可采用紫外线照射消毒,其原因是紫外线能______,在照射前,适量喷洒______,可强化消毒效果。
(4)水厂供应的自来水通常是经过______(填“氯气”“乙醇”或“高锰酸钾”)消毒的。
(5)某同学在使用高压蒸汽灭菌锅时,若压力达到设定要求,而锅内并没有达到相应温度,较可能的原因是______。40, [生物——选修3:现代生物科技专题]
某种荧光蛋白(GFP)在紫外光或蓝光激发下会发出绿色荧光,这一特性可用于检测细胞中目的基因的表达。某科研团队将某种病毒的外壳蛋白(L1)基因连接在GFP基因的5′末端,获得了L1-GFP融合基因(简称为甲),并将其插入质粒P0,构建了真核表达载体P1,其部分结构和酶切位点的示意图如下,图中E1~E4四种限制酶产生的黏性末端各不相同。
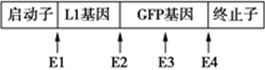
回答下列问题:
(1)据图推断,该团队在将甲插入质粒P0时,使用了两种限制酶,这两种酶是______。使用这两种酶进行酶切是为了增加______,也是为了增加______。
(2)将P1转入体外培养的牛皮肤细胞后,若在该细胞中观察到了绿色荧光,则说明L1基因在牛的皮肤细胞中完成了______和______过程。
(3)为了获得含有甲的牛,该团队需要做的工作包括:将能够产生绿色荧光细胞的______移入牛的______中、体外培养、胚胎移植等。
(4)为了检测甲是否存在于克隆牛的不同组织细胞中,某同学用PCR方法进行鉴定。在鉴定时应分别以该牛不同组织细胞中的______(填“mRNA”“总RNA”或“核DNA”)作为PCR模板。
#p#副标题#e#
----参考答案----
【1题】
[答案]:C
[解析]: 由题意可知,该题考查的是蛋白质的功能的相关知识,选项所描述的是几种常见的蛋白质的功能及其相关知识。
【详解】
抗原能和特异性抗体相结合,病毒、细菌等病原体表面的蛋白质等物质,都可以作为引起免疫反应的抗原,可见,浆细胞产生的抗体可结合相应的病毒抗原,A正确;肌肉细胞中的某些蛋白质(如肌动蛋白等)参与肌肉收缩的过程,B正确;蛋白质结合Fe2+形成的血红蛋白参与O2的运输,C错误;染色体是细胞核的结构之一,染色体主要由DNA和蛋白质组成,D正确。
[点评]:【】
本题以蛋白质的功能为主线,综合考查考生对体液免疫、组成肌肉细胞的肌动蛋白等蛋白质与血红蛋白的功能、细胞核的结构及染色体的组成、无机盐的功能等相关知识的识记和理解能力。解决此类问题,除了需要考生熟记并理解相关的基础知识、形成知识网络外,在平时的学习中要善于进行横向联系,即对教材中与某一知识有关的内容横向辐射,进行归纳。
【2题】
[答案]:C
[解析]: 本题考查细胞的物质输入与输出,具体涉及了被动运输(包括自由扩散和协助扩散)、主动运输和胞吞等方式,意图考查学生对相关知识点的理解能力。
【详解】
病原体属于颗粒性物质,颗粒性物质或大分子物质进出细胞的方式为胞吞和胞吐,因此巨噬细胞摄入病原体的过程属于胞吞,A错误;固醇类激素的化学本质是脂质,脂溶性物质以自由扩散的方式进入靶细胞,B错误;神经细胞内的Na+浓度比细胞膜外低,受刺激时,产生的Na+内流是顺浓度梯度进行的,属于被动运输,C正确;甘油是脂溶性小分子物质,以自由扩散的方式进入细胞,D错误。
[点评]:【】
【3题】
[答案]:D
[解析]: 由题意和选项的描述可知:该题考查激素调节及其实例(血糖调节)等相关知识。理清肾上腺素和性激素的功能、血糖调节过程、激素调节的特点是正确分析各选项的关键。
【详解】
人体运动时,肾上腺素水平升高,给细胞传达一种调节代谢的信息,引起心律加快,增加心输出量,进而增强细胞代谢速率,为身体活动提供更多能量,可见激素不是高能化合物,而是信息分子,A错误;饥饿时,血糖浓度低,刺激胰岛A细胞分泌更多的胰高血糖素,胰高血糖素与相应靶细胞膜上的受体结合,进而促进靶细胞内的糖原分解,但胰高血糖素不具有酶的催化活性,B错误;进食后,食物中的糖类经消化吸收导致血糖浓度升高,刺激胰岛B细胞分泌更多的胰岛素,胰岛素通过促进葡萄糖进入组织细胞及其在组织细胞内氧化分解、合成糖原等生理过程而降低血糖浓度,但其不能作为细胞的结构组分,C错误;青春期,性腺分泌的性激素水平升高,性激素随体液运输到达靶细胞,与相应的受体结合,促进生殖器官的发育以及生殖细胞的形成,D正确。
[点评]:【】
激素是一种信号分子,既不组成细胞结构,又不提供能量,也不起催化作用,而是随体液到达靶细胞,使靶细胞原有的生理活动发生变化。
【4题】
[答案]:C
[解析]: 由题文“种子入库前需要经过风干处理”可知,该题考查的是水的存在形式及其与细胞呼吸等代谢活动的关系。
【详解】
风干的种子中自由水含量极少,细胞呼吸作用强度弱,因此有机物消耗减慢,A正确,C错误;风干的种子含水量少,不利于微生物的生长繁殖,B正确;风干的种子中自由水含量极少,导致结合水与自由水的比值增大,D正确。
[点评]:【】
种子风干的过程中自由水含量逐渐降低。在范围内,自由水与结合水比值的大小决定了细胞或生物体的代谢强度:比值越大说明细胞(或生物体)中自由水含量越多,代谢越强;反之,代谢越弱。
【5题】
[答案]:B
[解析]: 本题以“病毒”为情境,考查了几种常见的DNA病毒和RNA病毒及其宿主等相关内容,选项命题角度新颖,试题较易。
【详解】
烟草花叶病毒的遗传物质是RNA,因此从烟草花叶病毒中可以提取到RNA,A正确;T2噬菌体是一种寄生在大肠杆菌体内的病毒,可见,T2噬菌体可感染大肠杆菌导致其裂解,B错误;艾滋病的全称是获得性免疫缺陷综合征,其发病机理是HIV病毒主要侵染T细胞,使机体几乎丧失一切免疫功能,C正确;阻断病毒的传播,是保护易感人群的有效措施之一,可降低其所致疾病的发病率,D正确。
[点评]:【】
根据遗传物质的不同,将病毒分为DNA病毒(如T2噬菌体)和RNA病毒(如烟草花叶病毒、流感病毒、HIV等)。T2噬菌体是一种寄生在大肠杆菌体内的病毒,HIV病毒主要侵染T细胞,导致人患获得性免疫缺陷综合征。
【6题】
[答案]:A
[解析]: 依题意可知:本题是对细胞癌变的原因及其癌细胞特点的考查。理清相应的基础知识、形成清晰的知识网络,据此分析各选项。
【详解】
细胞癌变的发生并不是单一基因突变的结果,而是一系列的原癌基因与抑癌基因的变异逐渐积累的结果,癌细胞的形态结构发生显著变化,其细胞膜上的糖蛋白减少,细胞间的黏着性降低,A错误,B正确;原癌基因主要负责调节细胞周期,控制细胞生长和分裂的进程,抑癌基因主要是阻止细胞不正常的增殖,如果细胞中的染色体受到损伤,导致原癌基因或抑癌基因随着它们所在的染色体片段一起丢失,则可能会出现细胞的增殖失去控制,C正确;综上分析,癌细胞中遗传物质(DNA)可能受到损伤,细胞表面的糖蛋白减少,D正确。
[点评]:【】
本题的易错点在于:误认为只要相关的单一基因突变就能引发细胞癌变;事实上,细胞癌变是一系列的原癌基因与抑癌基因的变异逐渐积累的结果。本题的难点在于对C 选项中的“染色体可能受到损伤”的理解;如果能联想到“基因与染色体的位置存在平行关系”,则会有一种“豁然开朗”的感觉。
【7题】
[答案]:D
[解析]: A. 碳酸钠水解溶液显碱性,因此可用于去除餐具的油污,A正确;
B. 漂白粉具有强氧化性,可用于生活用水的消毒,B正确;
C. 氢氧化铝是两性氢氧化物,能与酸反应,可用于中和过多胃酸,C正确;
D. 碳酸钡难溶于水,但可溶于酸,生成可溶性钡盐而使蛋白质变性,所以不能用于胃肠X射线造影检查,应该用硫酸钡,D错误。答案选D。
[点评]:【分析】
A.碳酸钠溶液显碱性;
B.漂白粉具有强氧化性;
C.氢氧化铝能与酸反应;
D.碳酸钡可溶于酸。
【教育】
本题主要是考查常见化学物质的性质和用途判断,题目难度不大。平时注意相关基础知识的积累并能灵活应用即可,注意碳酸钡与硫酸钡的性质差异。
【8题】
[答案]:C
[解析]: A. 雾的分散剂是空气,分散质是水。霾的分散剂是空气,分散质固体颗粒。因此雾和霾的分散剂相同,A正确;
B. 由于氮氧化物和二氧化硫转化为铵盐形成无机颗粒物,因此雾霾中含有硝酸铵和硫酸铵,B正确;
C. NH3作为反应物参加反应转化为铵盐,因此氨气不是形成无机颗粒物的催化剂,C错误;
D. 氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关,由于氮肥会释放出氨气,因此雾霾的形成与过度施用氮肥有关,D正确。答案选C。
[点评]:【分析】
A.雾和霾的分散剂均是空气;
B.根据示意图分析;
C.在化学反应里能改变反应物化学反应速率(增强或降低)而不改变化学平衡,且本身的质量和化学性质在化学反应前后都没有发生改变的物质叫催化剂;
D.氮肥会释放出氨气。
【教育】
结合示意图的转化关系明确雾霾的形成原理是解答的关键,氨气作用判断是解答的易错点。本题情境真实,应用导向,聚焦学科素养,既可以引导考生认识与化学有关的社会热点问题,形成可持续发展的意识和绿色化学观念,又体现了高考评价体系中的应用性和综合性考查要求。
【9题】
[答案]:D
[解析]: 在光照条件下氯气与甲烷发生取代反应生成氯化氢和四种氯代烃,氯化氢极易溶于水,所以液面会上升。但氯代烃是不溶于水的气体或油状液体,所以较终水不会充满试管,答案选D。
[点评]:【分析】
在光照条件下氯气与甲烷发生取代反应生成氯化氢和四种氯代烃,结合有关物质的溶解性分析解答。
【教育】
明确甲烷发生取代反应的原理和有关物质的溶解性是解答的关键,本题取自教材中学生比较熟悉的实验,难度不大,体现了依据大纲,回归教材,考查学科收藏知识,体现高考评价体系中的基础性考查要求。
【10题】
[答案]:A
[解析]: 根据以上分析可知W、X、Y和Z分别是N、O、Na、Cl。则
A. 氧元素与其N、Na、Cl三种元素均可形成两种或两种以上的二元化合物,例如NO、NO2、Na2O、Na2O2、Cl2O7、ClO2等,A正确;
B. 过氧化钠中含有离子键和共价键,B错误;
C. N、O、Na三种元素的简单离子具有相同的电子层结构,均是10电子,氯离子是18电子微粒,C错误;
D. 亚硝酸为弱酸,D错误。答案选A。
[点评]:【分析】
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体,W是N,X是O;Y的周期数是族序数的3倍,因此Y只能是第三周期,所以Y是Na;Z原子较外层的电子数与W的电子总数相同,Z的较外层电子数是7个,Z是Cl,结合元素周期律和物质的性质解答。
【教育】
本题考查元素周期表和元素周期律的知识,准确判断出元素是解答的关键,红棕色气体是解答的冲刺点,该类试题与元素化合物的知识结合的比较多,元素推断只是一种载体,注意掌握常见单质及其化合物的性质、典型用途、制备等。
【11题】
[答案]:C
[解析]: A. 常温常压下,124 g P4的物质的量是1mol,由于白磷是正四面体结构,含有6个P-P键,因此其中所含P—P键数目为6NA,A错误;
B. 铁离子在溶液中水解,所以100 mL 1mol•L−1FeCl3溶液中所含Fe3+的数目小于0.1NA,B错误;
C. 甲烷和乙烯分子均含有4个氢原子,标准状况下,11.2 L甲烷和乙烯混合物的物质的量是0.5mol,其中含氢原子数目为2NA,C正确;
D. 反应2SO2+O2[点评]:【分析】
A.根据白磷是正四面体结构分析;
B.根据铁离子水解分析;
C.根据甲烷和乙烯均含有4个氢原子分析;
D.根据反应是可逆反应判断。
【教育】
本题主要是考查阿伏加德罗常数的应用,是高考的一个高频考点,主要从物质结构、水解、转移电子、可逆反应等角度考查,本题相对比较容易,只要认真、细心就能做对,平时多注意这方面的积累。白磷的结构是解答的难点,注意与甲烷正四面体结构的区别。
【12题】
[答案]:D
[解析]: A. 放电时是原电池,阴离子[点评]:【分析】
原电池中负极发生失去电子的氧化反应,正极发生得到电子的还原反应,阳离子向正极移动,阴离子向负极移动,充电可以看作是放电的逆反应,据此解答。
【教育】
本题以我国科学家发表在化学刊物上的“一种室温下可呼吸的钠、二氧化碳二次电池”为载体考查了原电池和电解池的工作原理,掌握原电池和电解池的工作原理是解答的关键,注意充电与发电关系的理解。本题很好的弘扬了社会主义价值观个人层面的爱国精神,落实了立德树人的教育根本任务。
【13题】
[答案]:B
[解析]: A.氢氧化钠溶于水放热,因此溶解后需要冷却到室温下再转移至容量瓶中,A错误;
B.氯化铁具有氧化性,能被维生素C还原为氯化亚铁,从而使溶液颜色发生变化,所以向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,通过观察颜色变化可以探究维生素C的还原性,B正确;
C.向稀盐酸中加入锌粒,生成氢气,由于生成的氢气中含有氯化氢和水蒸气,因此将生成的气体依次通过NaOH溶液、浓硫酸即可,不需要通过KMnO4溶液,或者直接通过碱石灰,C错误;
D.反应的方程式为[点评]:【分析】
A.氢氧化钠溶于水放热;
B.根据铁离子具有氧化性结合溶液颜色变化分析;
C.氢气中含有氯化氢和水蒸气,据此解答;
D.根据双氧水与亚硫酸氢钠反应的实验现象分析。
【教育】
明确相关物质的性质特点、发生的反应和实验原理是解答的关键。注意设计或评价实验时主要从正确与错误、严密与不严密、准确与不准确、可行与不可行等方面作出判断。另外有无干扰、是否经济、是否安全、有无污染等也是要考虑的。本题中选项D是解答的易错点,学生往往只考虑物质的浓度不同,而忽略了实验结论需要建立在实验现象的基础上。
【14题】
[答案]:A
[解析]: 受力分析,找到能影响动能变化的是那几个物理量,然后观测这几个物理量的变化即可。
木箱受力如图所示:
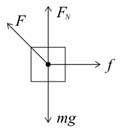
木箱在移动的过程中有两个力做功,拉力做正功,摩擦力做负功,
根据动能定理可知即:WF−Wf=12mv2−0WF−Wf=12mv2−0 ,所以动能小于拉力做的功,故A正确;无法比较动能与摩擦力做功的大小,CD错误。故选A
[点评]:【】:
正确受力分析,知道木箱在运动过程中有那几个力做功且分别做什么功,然后利用动能定理求解末动能的大小。
【15题】
[答案]:C
[解析]: 本题是一道估算题,所以大致要知道一层楼的高度约为3m,可以利用动能定理或者机械能守恒求落地时的速度,并利用动量定理求力的大小。
设鸡蛋落地瞬间的速度为v,每层楼的高度大约是3m,
由动能定理可知:mgh=12mv2mgh=12mv2 ,
解得:v=2gh−−−√=2×10×3×25−−−−−−−−−−−−−√=1015−−√m/sv=2gh=2×10×3×25=1015m/s
落地时受到自身的重力和地面的支持力,规定向上为正,
由动量定理可知:(N−mg)t=0−(−mv)(N−mg)t=0−(−mv) ,解得:N≈1000NN≈1000N ,
根据牛顿第三定律可知鸡蛋对地面产生的冲击力约为103N,故C正确。故选C
[点评]:【】:
利用动能定理求出落地时的速度,然后借助于动量定理求出地面的接触力
【16题】
[答案]:C
[解析]: 在天体中万有引力提供向心力,即GMmR2=m(2πT)2RGMmR2=m(2πT)2R,天体的密度公式ρ=MV=M43πR3ρ=MV=M43πR3,结合这两个公式求解。
设脉冲星质量为M,密度为ρρ
根据天体运动规律知:GMmR2≥m(2πT)2RGMmR2≥m(2πT)2R
ρ=MV=M43πR3ρ=MV=M43πR3
代入可得:ρ≈5×1015kg/m3ρ≈5×1015kg/m3 ,故C正确;故选C
[点评]:【】:
根据万有引力提供向心力并结合密度公式ρ=MV=M43πR3ρ=MV=M43πR3求解即可。
【17题】
[答案]:B
[解析]: 知道光电效应方程Ek=hν−W0Ek=hν−W0;知道逸出功W0=hν0W0=hν0并结合两个公式求解。
由光电效应方程式得:
Ek=hν−W0Ek=hν−W0
得:W0=hν−Ek=hcλ−EkW0=hν−Ek=hcλ−Ek
刚好发生光电效应的临界频率为ν0ν0
则W0=hν0W0=hν0
代入数据可得:ν0=8×1014Hzν0=8×1014Hz ,故B正确;故选B
[点评]:【】:
本题比较简单,知道光电效应方程并利用方程求解即可。
【18题】
[答案]:D
[解析]: 找到线框在移动过程中谁切割磁感线,并根据右手定则判断电流的方向,从而判断整个回路中总电流的方向。要分过程处理本题。
第一过程从①移动②的过程中
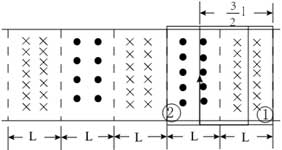
左边导体棒切割产生的电流方向是顺时针,右边切割磁感线产生的电流方向也是顺时针,两根棒切割产生电动势方向相同所以E=2BlvE=2Blv,则电流为i=ER=2BlvRi=ER=2BlvR,电流恒定且方向为顺时针,
再从②移动到③的过程中左右两根棒切割磁感线产生的电流大小相等,方向相反,所以回路中电流表现为零,
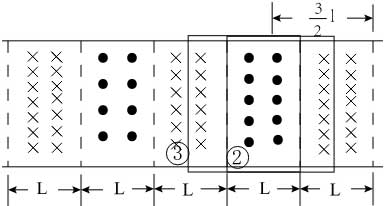
然后从③到④的过程中,左边切割产生的电流方向逆时针,而右边切割产生的电流方向也是逆时针,所以电流的大小为i=ER=2BlvRi=ER=2BlvR,方向是逆时针
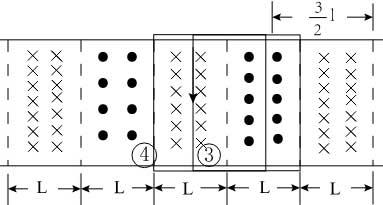
当线框再向左运动时,左边切割产生的电流方向顺时针,右边切割产生的电流方向是逆时针,此时回路中电流表现为零,故线圈在运动过程中电流是周期性变化,故D正确;故选D
[点评]:【】:
根据线圈的运动利用楞次定律找到电流的方向,并计算电流的大小从而找到符合题意的图像。
【19题】
[答案]:B,D
[解析]: 在v-t图像中图像包围的面积代表了运动走过的位移,图像的斜率代表加速度,解本题要利用这个知识点求解。
AB,v-t图像中图像包围的面积代表运动走过的位移,两车在t2时刻并排行驶,利用逆向思维并借助于面积可知在t1时刻甲车在后,乙车在前,故A错误,B正确;
CD、图像的斜率表示加速度,所以甲的加速度先减小后增大,乙的加速度也是先减小后增大,故C错D正确;故选BD
[点评]:【】:
本题考查了对图像的理解及利用图像解题的能力问题
【20题】
[答案]:A,C
[解析]: 先利用右手定则判断通电导线各自产生的磁场强度,然后在利用矢量叠加的方式求解各个导体棒产生的磁场强度。
L1在ab两点产生的磁场强度大小相等设为B1,方向都垂直于纸面向里,而L2在a点产生的磁场强度设为B2,方向向里,在b点产生的磁场强度也为B2,方向向外,规定向外为正,根据矢量叠加原理可知
B0−B1−B2=13B0B0−B1−B2=13B0
B2+B0−B1=12B0B2+B0−B1=12B0
可解得:B1=712B0B1=712B0 ;B2=112B0B2=112B0 故AC正确;故选AC
[点评]:【】:
磁场强度是矢量,对于此题来说ab两点的磁场强度是由三个磁场的叠加形成,先根据右手定则判断导线在ab两点产生的磁场方向,在利用矢量叠加来求解即可。
【21题】
[答案]:B,D
[解析]: 利用电场力做功W=qUW=qU,可以找到两点之间电势差的关系,要知道中点电势和两端点电势之间的关系。
A、选项根据题意无法判断,故A项错误。
B、由于电场为匀强磁场,M为a、c连线的中点,N为b、d连线的中点,所以φM=φc−φc−φa2=φc+φa2φM=φc−φc−φa2=φc+φa2
φN=φd−φd−φb2=φd+φb2φN=φd−φd−φb2=φd+φb2
若该粒子从M点移动到N点,则电场力做功为
W=qUMN=q(φM−φN)=qφc+φa2−qφd+φb2=qUcd+qUab2=W1+W22W=qUMN=q(φM−φN)=qφc+φa2−qφd+φb2=qUcd+qUab2=W1+W22,故B正确;
C、因为不知道匀强电场方向,所以场强大小不是W2qLW2qL,故C错误;
D、若W1=W2,说明Ucd=UabUcd=Uab
UaM−UbN=(φa−φM)−(φb−φN)UaM−UbN=(φa−φM)−(φb−φN)
由因为φM=φc−φc−φa2=φc+φa2φM=φc−φc−φa2=φc+φa2;φN=φd−φd−φb2=φd+φb2φN=φd−φd−φb2=φd+φb2
解得:UaM−UbN=0UaM−UbN=0 ,故D正确;故选BD
[点评]:【】:
对匀强电场的电场特征要了解,利用电场力做功与电势差之间的关系求解。
【22题】
[答案]: (1)如图所示
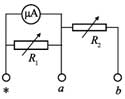
(2)100;2910
[解析]: (1)R1的电阻比较小,所以R1与表头并联构成大量程的的电流表,R2的阻值比较大,与改装后的电流表串联可充当大量程的电压表,设计电路图如图所示;

并联后的总电阻为R′=90ΩR′=90Ω
要改装3V电压表需要串联电阻,串联电阻的阻值为[点评]:【】:
利用串并联的关系求解改装电表时需要串联的电阻或者并联的电阻大小。
【23题】
[答案]: (1)2.75
(2)如图所示
(3)μ(M+m)g;μg
(4)0.40
[解析]: ①描点连线时要注意让点均匀分布在线上或线的两边
②要结合图像坐标整理出相应的数学函数,然后观测斜率和截距分别代表什么。
(1)指针在2.7与2.8之间,估读为2.75N2.75N
(2)描点画线注意让点均匀分布在线上或线的两边,作图如下:

(3)木块受到的是滑动摩擦力,根据滑动摩擦力的定义知f=μ(M+m)gf=μ(M+m)g
把公式化简可得:f=μ(M+m)g=(μg)m+μMgf=μ(M+m)g=(μg)m+μMg
所以图像的斜率k=μgk=μg
(4)取g=9.80 m/s2s2,取图像上相距较远的两点求斜率k=2.94−2.160.25−0.05=3.9k=2.94−2.160.25−0.05=3.9
则μ=kg=3.99.8≈0.40μ=kg=3.99.8≈0.40
[点评]:【】:
在描点连线时要注意尽可能让点在直线上,如果没法在直线上也要均匀分布在直线的两侧,来减小误差。
【24题】
[答案]: (1)vB′=3.0m/svB′=3.0m/s
(2)vA=4.3m/svA=4.3m/s
[解析]: 两车碰撞过程动量守恒,碰后两车在摩擦力的作用下做匀减速运动,利用运动学公式可以求得碰后的速度,然后在计算碰前A车的速度。
(1)设B车质量为mB,碰后加速度大小为aB,根据牛顿第二定律有
μmBg=mBaBμmBg=mBaB ①
式中μ是汽车与路面间的动摩擦因数。
设碰撞后瞬间B车速度的大小为vB′vB′,碰撞后滑行的距离为sBsB。由运动学公式有
vB′2=2aBsBvB′2=2aBsB ②
联立①②式并利用题给数据得
vB′=3.0m/svB′=3.0m/s ③
(2)设A车的质量为mA,碰后加速度大小为aA。根据牛顿第二定律有
μmAg=mAaAμmAg=mAaA ④
设碰撞后瞬间A车速度的大小为vA′vA′,碰撞后滑行的距离为sAsA。由运动学公式有
vA′2=2aAsAvA′2=2aAsA ⑤
设碰撞后瞬间A车速度的大小为vAvA,两车在碰撞过程中动量守恒,有
mAvA=mAvA′+mBvB′mAvA=mAvA′+mBvB′ ⑥
联立③④⑤⑥式并利用题给数据得
vA=4.3m/svA=4.3m/s
[点评]:【】:灵活运用运动学公式及碰撞时动量守恒来解题。
【25题】
[答案]: (1)轨迹图如图所示:
(2)v0=2El′Blv0=2El′Bl
(3)qm=43√El′B2l2qm=43El′B2l2;t′=BlE(1+3√πl18l′)t′=BlE(1+3πl18l′)
[解析]: (1)粒子在电场中做类平抛,然后进入磁场做圆周运动,再次进入电场做类平抛运动,结合相应的计算即可画出轨迹图
(2)在电场中要分两个方向处理问题,一个方向做匀速运动,一个方向做匀加速运动。
(3)在磁场中的运动关键是找到圆心,求出半径,结合向心力公式求解。
(1)粒子运动的轨迹如图(a)所示。(粒子在电场中的轨迹为抛物线,在磁场中为圆弧,上下对称)

(2)粒子从电场下边界入射后在电场中做类平抛运动。设粒子从M点射入时速度的大小为v0,在下侧电场中运动的时间为t,加速度的大小为a;粒子进入磁场的速度大小为v,方向与电场方向的夹角为θθ(见图(b)),速度沿电场方向的分量为v1,根据牛顿第二定律有
qE=ma ①
式中q和m分别为粒子的电荷量和质量,由运动学公式有
v1=at ②
l′=v0tl′=v0t ③
v1=vcosθv1=vcosθ ④
粒子在磁场中做匀速圆周运动,设其运动轨道半径为R,由洛伦兹力公式和牛顿第二定律得
qvB=mv2RqvB=mv2R ⑤
由几何关系得
l=2Rcosθl=2Rcosθ ⑥
联立①②③④⑤⑥式得
v0=2El′Blv0=2El′Bl ⑦
(3)由运动学公式和题给数据得
v1=v0cotπ6v1=v0cotπ6 ⑧
联立①②③⑦⑧式得
qm=43√El′B2l2qm=43El′B2l2 ⑨
设粒子由M点运动到N点所用的时间为t′t′,则
t′=2t+2(π2−π6)2πTt′=2t+2(π2−π6)2πT ⑩
式中T是粒子在磁场中做匀速圆周运动的周期,
T=2πmqBT=2πmqB ⑪
由③⑦⑨⑩⑪式得
t′=BlE(1+3√πl18l′)t′=BlE(1+3πl18l′) ⑫
[点评]:【】:
在复合场中的运动要分阶段处理,每一个运动建立合理的公式即可求出待求的物理量。
【26题】
[答案]: (1)ZnS+3232O2(2)PbSO4
(3)调节溶液的pH
(4)无法除去杂质Fe2+
(5)Zn+Cd2+(7)溶浸
[解析]: (1)由于闪锌矿的主要成分是ZnS,因此焙烧过程中主要反应的化学方程式为2ZnS+3O2(2)由于硫酸铅不溶于水,因此滤渣1的主要成分除SiO2外还有PbSO4;要测定铁离子,需要调节溶液的pH,又因为不能引入新杂质,所以需要利用氧化锌调节pH,即氧化除杂工序中ZnO的作用是调节溶液的pH。根据表中数据可知沉淀亚铁离子的pH较大,所以若不通入氧气,其后果是无法除去杂质Fe2+。
(3)溶液中的Cd2+可用锌粉除去,反应的离子方程式为Zn+Cd2+=Zn2++Cd。
(4)电解硫酸锌溶液制备单质锌时,阴极发生得到电子的还原反应,因此阴极是锌离子放电,则阴极的电极反应式为Zn2++2e-=Zn;阳极是氢氧根放电,破坏水的电离平衡,产生氢离子,所以电解后还有硫酸产生,因此沉积锌后的电解液可返回溶浸工序继续使用。
[点评]:【分析】
焙烧时硫元素转化为SO2,然后用稀硫酸溶浸,生成硫酸锌、硫酸亚铁和硫酸镉,二氧化硅与稀硫酸不反应转化为滤渣,由于硫酸铅不溶于水,因此滤渣1中还含有硫酸铅。由于沉淀亚铁离子的pH较大,需要将其氧化为铁离子,通过控制pH得到氢氧化铁沉淀;滤液中加入锌粉置换出Cd,较后将滤液电解得到金属锌,据此将解答。
【教育】
无机工业流程题能够以真实的工业生产过程为背景,体现能力立意的命题为指导思想,能够综合考查学生各方面的基础知识及将已有知识灵活应用在生产实际中解决问题的能力。解决本类题目的关键是分析流程中的每一步骤,可从以下几个方面了解流程:①反应物是什么;②发生了什么反应;③该反应造成了什么后果,对制造产品有什么作用。即抓住一个关键点:一切反应或操作都是为获得产品而服务的。另外本题中呈现的内容展示了中华科技成果对人类发展和社会进步的贡献,可以引导学生自觉传承我国科学文化,弘扬科学精神。
【27题】
[答案]: (1)247
(2)A
(3)1313
(4)劣于
(5)相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大
(6)AD
(7)pc(CO2)、pb(CO2)、pa(CO2)
[解析]: (1)已知:
①C(s)+2H2(g)=CH4(g) ΔH=-75 kJ•mol−1
②C(s)+O2(g)=CO2(g) ΔH=-394 kJ•mol−1
③C(s)+1/2O2(g)=CO(g) ΔH=-111 kJ•mol−1
根据盖斯定律可知③×2-②-①即得到该催化重整反应CH4(g)+CO2(g)=2CO(g)+2H2(g)的ΔH=+247 kJ•mol−1。正反应是体积增大的吸热反应,所以有利于增强CH4平衡转化率的条件是高温低压,答案选A;某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,根据方程式可知
CH4(g)+CO2(g)=2CO(g)+2H2(g)
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.25 0.25 0.5 0.5
平衡浓度(mol/L) 0.75 0.25 0.5 0.5
所以其平衡常数为0.52×0.520.75×0.25=130.52×0.520.75×0.25=13mol2•L−2。
(2)①根据表中数据可知相对于催化剂X,催化剂Y积碳反应的活化能大,积碳反应的速率小;而消碳反应活化能相对小,消碳反应速率大,所以催化剂X劣于Y。A.正反应均是吸热反应,升高温度平衡向正反应方向进行,因此K积、K消均增加,A正确;B.升高温度反应速率均增大,B错误;C.根据A中分析可知选项C错误;D.积碳量达到较大值以后再升高温度积碳量降低,这说明v消增加的倍数比v积增加的倍数大,D正确。答案选AD。
②根据反应速率方程式可知在p(CH4)时,生成速率随p(CO2)的升高而降低,所以根据图像可知pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为pc(CO2)、pb(CO2)、pa(CO2)。
[点评]:【分析】
(1)根据盖斯定律计算;根据反应特点结合温度和压强对平衡状态的影响解答;根据转化率利用三段式计算平衡常数;
(2)①根据活化能对反应的影响分析;根据反应热结合温度对平衡状态的影响以及图像曲线变化趋势解答;
②根据反应速率方程式分析影响其因素结合图像解答。
【教育】
本题主要是考查影响化学平衡的因素,化学图像的分析与判断,化学计算等知识。图像分析是解答的易错点和难点,注意化学平衡图像分析的答题技巧,看图像时:①一看面:纵坐标与横坐标的意义;②二看线:线的走向和变化趋势;③三看点:起点,拐点,终点,然后根据图象中呈现的关系、题给信息和所学知识相结合,做出符合题目要求的解答。
【28题】
[答案]: (1)3FeC2O4+2K3[Fe(CN)6](2)隔绝空气、使反应产生的气体全部进入后续装置
(3)CO2
(4)CO
(5)先熄灭装置A、E的酒精灯,冷却后停止通入氮气
(6)取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3
(7)粉红色出现
(8)5cV×561000m×5cV×561000m×
[解析]: (1)光解反应的化学方程式为2K3[Fe(C2O4)3](2)①装置中的空气在高温下能氧化金属铜,能影响E中的反应,所以反应前通入氮气的目的是隔绝空气排尽装置中的空气;反应中有气体生成,不会全部进入后续装置。
②实验中观察到装置B、F中澄清石灰水均变浑浊,说明反应中产生二氧化碳。装置E中固体变为红色,说明氧化铜被还原为铜,即有还原性气体CO生成,由此判断热分解产物中含有CO2、CO;
③为防止倒吸,需要增加装置中保持的压力,所以停止实验时应进行的操作是先熄灭装置A、E的酒精灯,冷却后停止通入氮气即可。
④要检验Fe2O3存在首先要转化为可溶性铁盐,因此方法是取少许固体粉末于试管中,加稀硫酸溶解,滴入1~2滴KSCN溶液,溶液变红色,证明含有Fe2O3。
(3)①高锰酸钾氧化草酸根离子,其溶液显红色,所以滴定终点的现象是粉红色出现。
②锌把铁离子还原为亚铁离子,酸性高锰酸钾溶液又把亚铁离子氧化为铁离子。反应中消耗高锰酸钾是0.001cVmol,Mn元素化合价从+7价降低到+2价,所以根据电子得失守恒可知铁离子的物质的量是0.005cVmol,则该晶体中铁的质量分数的表达式为0.005cV×56m×=5cV×561000m×0.005cV×56m×=5cV×561000m×。
[点评]:【分析】
(1)根据亚铁离子能与K3[Fe(CN)6]发生显色反应解答;
(2)①根据氮气能隔绝空气和排尽气体分析;
②根据CO2、CO的性质分析;
③要防止倒吸可以根据外界条件对压强的影响分析;
③根据铁离子的检验方法解答;
(3)①根据酸性高锰酸钾溶液显红色 ;
②根据电子得失守恒计算。
【教育】
本题主要是考查物质分解产物检验、元素含量测定等实验方案设计与评价,题目难度中等,明确实验原理和相关物质的性质是解答的关键。关于化学实验从安全角度常考虑的主要因素如下:净化、吸收气体及熄灭酒精灯时要防止液体倒吸;进行某些易燃易爆实验时要防爆炸(如H2还原CuO应先通H2,气体点燃前先验纯等);防氧化(如H2还原CuO后要“先灭灯再停氢”,白磷切割宜在水中进行等);污染性的气体要进行尾气处理;有粉末状物质参加的反应,要注意防止导气管堵塞;防吸水(如实验取用、制取易吸水、潮解、水解的物质时宜采取需要措施,以增加达到实验目的)。
【29题】
[答案]: (1). ①手术但不切除垂体;切除垂体;③每隔时间,测定并记录两组大鼠的体重
(2). 生长;促甲状腺
[解析]: 本题采用切除法,以“研究垂体对机体生长发育的作用”为情境,考查考生的实验与探究能力。解题的关键是由题意准确把握实验目的(研究垂体对机体生长发育的作用),进而明辨实验变量(自变量、因变量、无关变量)。在此基础上,依据实验设计应遵循的原则,围绕给出的不完善的实验步骤,以及垂体分泌的与生长发育有关的激素等知识,对各问题情境进行解答。
【详解】
(1)依题意可知:本实验的自变量是垂体的有无,因变量是通过检测幼龄大鼠的体重变化来反映其生长发育的状况,其他对实验结果有影响的因变量应控制相同且适宜。据此结合题意所示的实验方法(切除法)、不完善的实验步骤和实验设计应遵循的原则可知,①A组(对照组) 手术但不切除垂体,B组(实验组)要切除垂体;③的内容为“每隔时间,测定并记录两组大鼠的体重”。
(2)垂体分泌的促甲状腺激素可促进甲状腺的正常生长发育,调节甲状腺激素的合成和分泌。垂体分泌的生长激素和甲状腺分泌的甲状腺激素都有促进生长发育的作用,但前者主要促进生长,后者主要促进发育,二者共同协调,机体才能正常的生长发育。可见,若B组大鼠生长发育的状况不如A组,则是由于B组的处理使大鼠缺失了来源于垂体的生长激素和促甲状腺激素。
[点评]:【】
解答实验题的切入点为找准实验目的,由此分析出实验的自变量和因变量,从而做到在实验设计或完善实验步骤中有的放矢。实验处理要遵循“单一变量和对照原则”,设立实验组和对照组时,注意控制无关变量,在措辞中往往有“相同”、“一致”等字眼;在培养(或饲养)、观察记录实验现象或记录测定的实验数据时,依然在措辞中体现对无关变量的控制,经常有“相同条件下”、“每隔时间”等字眼。把握上述要点,本题便可形成如下清晰的实验思路:
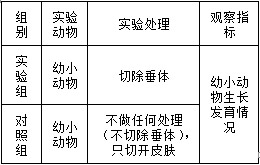
实验动物选取分组时,要选取生长发育状况相同的,且饲养时其他条件要一致。
【30题】
[答案]: (1). 下层;A叶片的净光合速率达到较大时所需光照强度低于B叶片
(2). 暗
(3). 无水乙醇
[解析]: 本题以反映实验结果的曲线图为情境,综合考查考生对绿叶中色素的提取、光合作用过程及其影响因素等相关知识的识记和理解能力。解题的关键是理解横纵坐标的含义,把握曲线走势。在此基础上结合题意并从图示中提取信息,围绕光合作用的过程及其影响的环境因素等相关知识,对各问题情境进行分析解答。
【详解】
(1)由于上层叶片对阳光的遮挡,导致下层叶片接受的光照强度较弱,因此下层叶片净光合速率达到较大值时所需要的光照强度较上层叶片低,据此分析图示可推知:A叶片是树冠下层的叶片。
(2)光合作用包括光反应和暗反应两个阶段,氧气产生于光反应阶段。光照强度达到数值时,A叶片的净光合速率开始下降,但测得放氧速率不变,说明光反应速率不变,则净光合速率降低的主要原因是光合作用的暗反应受到抑制。
(3)绿叶中的叶绿素等光合色素能够溶解在有机溶剂无水乙醇中,可以用无水乙醇提取叶绿素。
[点评]:【】
坐标曲线题的解题关键是:①要理解横、纵坐标的含义及曲线代表的含义,这是解题的重心所在。②关注坐标上的“四点、二量、一趋势”。“四点”指的是起点、交点、折点和终点;“二量”指的是分清自变量与因变量,不能颠倒;“一趋势”,指的是曲线的走势,特别要注意的是分析问题时要结合横轴的点、区段来进行。③分析曲线变化有关的知识点时,还要挖掘或捕捉题目所给予的有效信息。
【31题】
[答案]: (1). 生产者固定的能量在沿食物链流动过程中大部分都损失了,传递到下一营养级的能量较少
(2). 甲对肉食性动物的恐惧程度比乙高,肉食性动物引入后甲逃离该生态系统的数量比乙多
(3). 大型肉食性动物捕食野猪;野猪因恐惧减少了采食。
[解析]: 大型肉食性动物对低营养级肉食性动物与植食性动物的捕食和驱赶,会对群落或生态系统产生影响,据此,以这一建立在“威慑”与“恐惧”基础上的种间关系(捕食和驱赶)为切入点并与生态系统的能量流动建立联系,结合题意,对相应问题进行解答。
【详解】
(1)生产者固定的太阳能总量是流入一个生态系统的总能量。能量在沿着食物链和食物网流动的过程中,各个营养级的生物都会通过自身的呼吸作用而消耗一部分能量(以热能的形式散失),余下的用于生长发育和繁殖等生命活动的能量中,也有一部分随着残枝败叶或遗体残骸等被分解者分解释放出来而不能输入到下一营养级,即生产者固定的能量在沿食物链流动的过程中大部分损失了,传递到下一营养级的能量较少,因此食物链中的营养级数量一般不会太多。
(2)依题意可知:肉食性动物的引入,使得甲、乙两种植食性动物间的竞争结果发生了反转(甲的数量优势地位丧失),而该反转不是由于肉食性动物的直接捕食造成的,进而推知,甲的数量优势地位丧失的可能原因是:肉食性动物对甲、乙的驱赶作用而引起的甲、乙的“恐惧”程度不同,甲对肉食性动物的“恐惧”程度比乙高,肉食性动物引入后甲逃离该生态系统的数量比乙多。
(3)某种大型肉食性动物在某地区的森林中重新出现,会减轻该地区野猪对农作物的破坏程度,由题意中“恐惧生态学”的知识可推知,其可能的原因有:一是该种大型肉食性动物对野猪的直接捕食而导致野猪的个体数减少,二是野猪因“恐惧”减少了采食。
[点评]:【】
本题的难点在于对(2)(3)的解答。解题的关键是准确把握题意中“恐惧生态学”知识的内涵,抓住“捕食和驱赶”这一关键信息,并结合题意分析大型肉食性动物对相应的低营养级动物种群数量的影响。
【32题】
[答案]: (1). ZAZA,ZaW;ZAW、ZAZa,雌雄均为正常眼;1/2
(2). 杂交组合:豁眼雄禽(ZaZa)×正常眼雌禽(ZAW)
预期结果:子代雌禽为豁眼(ZaW),雄禽为正常眼(ZAZa)
(3). ZaWmm;ZaZaMm,ZaZamm
[解析]: 理清“基因的分离定律、伴性遗传、基因的自由组合定律”等相关知识,形成清晰的知识网络。在此基础上,依据上述相关知识并围绕题意,准确定位亲本的基因型,推知子代(F1或F2)的基因型、表现型及其相应的性状分离比,进而对相关问题进行解答。
【详解】
(1)依题意可知,在家禽中,雄性的性染色体组成为ZZ,雌性的性染色体组成为ZW,豁眼性状由Z染色体上的隐性基因a控制,且在W染色体上没有其等位基因。由此推知,亲本纯合体正常眼雄禽的基因型为ZAZA,亲本豁眼雌禽的基因型为ZaW,二者杂交所得F1的基因型为ZAZa、ZAW,F1的雌雄个体均为正常眼。F1的雌雄个体交配,所得F2的基因型及其比例为ZAZA∶ZAZa∶ZAW∶ZaW=1∶1∶1∶1,可见,F2雌禽中豁眼禽(ZaW)所占的比例为1/2。
(2)雌性亲本将Z染色体遗传给子代的雄性,将W染色体遗传给子代的雌性,而子代的雌性的Z染色体则来自雄性亲本。可见,若使子代中的雌禽均为豁眼(ZaW)、雄禽均为正常眼(ZAZ-),则亲本的杂交组合为:豁眼雄禽(ZaZa)×正常眼雌禽(ZAW);该杂交组合产生的子代的基因型为ZAZa、ZaW,表现型为:子代雌禽均为豁眼(ZaW),雄禽均为正常眼(ZAZa)。
(3)依题意可知:m基因纯合时可使部分应表现为豁眼的个体表现为正常眼,而MM和Mm对个体眼的表现型无影响。两只表现型均为正常眼的亲本交配,其子代中出现豁眼雄禽,这说明子代中还存在正常眼雄禽(ZAZ-);因子代出现的豁眼雄禽的基因型为ZaZa,所以亲本雌禽必然含有Za,进而推知该亲本雌禽的基因型为ZaWmm,亲本雄禽的基因型为ZAZaMM或ZAZaMm或ZAZamm,子代中豁眼雄禽可能的基因型包括ZaZaMm、ZaZamm。
[点评]:【】
鸡的性别决定方式为ZW型,公鸡的性染色体组成为ZZ,母鸡的性染色体组成为ZW;基因的分离定律研究的是一对等位基因在传宗接代中的传递规律,若该对等位基因位于性染色体上,则同时还表现为伴性遗传;基因的自由组合定律研究的是位于非同源染色体上的非等位基因在传宗接代中的传递规律。据此以题意“Z染色体上的隐性基因a”和“M/m基因位于常染色体上”等信息为切入点,明辨相应基因在遗传时所遵循的遗传规律,有针对性地进行分析解答。
【33题】
[答案]:B,D,E
[解析]: ABCE:气体的内能等于分子热运动动能和分子之间势能的总和,故AC错,BE对;
D:根据热力学第律ΔU=W+QΔU=W+Q知道,改变内能的方式有做功和热传递,所以体积发生变化时,内能可能不变,故D正确;故选BDE
[点评]:【】:
不仅要知道内能是什么,还要知道改变内能的方式是什么。
【34题】
[答案]: W=(p0S+mg)hW=(p0S+mg)h
[解析]: 由于活塞处于平衡状态所以可以利用活塞处于平衡状态,求封闭气体的压强,然后找到不同状态下气体参量,计算温度或者体积。
开始时活塞位于a处,加热后,汽缸中的气体先经历等容过程,直至活塞开始运动。设此时汽缸中气体的温度为T1,压强为p1,根据查理定律有
p0T0=p1T1p0T0=p1T1①
根据力的平衡条件有
p1S=p0S+mgp1S=p0S+mg②
联立①②式可得
T1=(1+mgp0S)T0T1=(1+mgp0S)T0③
此后,汽缸中的气体经历等压过程,直至活塞刚好到达b处,设此时汽缸中气体的温度为T2;活塞位于a处和b处时气体的体积分别为V1和V2。根据盖—吕萨克定律有
V1T1=V2T2V1T1=V2T2④
式中
V1=SH⑤
V2=S(H+h)⑥
联立③④⑤⑥式解得
T2=(1+hH)(1+mgp0S)T0T2=(1+hH)(1+mgp0S)T0⑦
从开始加热到活塞到达b处的过程中,汽缸中的气体对外做的功为
W=(p0S+mg)hW=(p0S+mg)h⑧
[点评]:【】:
本题的关键是找到不同状态下的气体参量,再利用气态方程求解即可。
【35题】
[答案]: 365;2451724517
[解析]: 可以假设桥的长度,分别算出运动时间,结合题中的1s求桥长,在不同介质中传播时波的频率不会变化。
(1)设桥的长度为s
则声音在钢铁中传播的时间t=sv=s4900t=sv=s4900
声音在空气中的传播时间为t′=sv′=s340t′=sv′=s340
根据题意Δt=t′−t=s340−s4900=1Δt=t′−t=s340−s4900=1
解得:s=365ms=365m
(2)声音在不同介质中的频率是不会改变的,由公式可知λ=vfλ=vf ,[点评]:【】:
本题考查了波的传播的问题,知道不同介质中波的传播速度不同,当传播是的频率不会发生变化。
【36题】
[答案]: (1)δ=60°
(2)23√3≤n≤2233≤n≤2
[解析]: (1)根据题意画出光路图,根据几何关系找到出射光线与入射光线之间的夹角;
(2)要增加在E点发生全反射,则在E点的入射角要大于等于临界角C
(ⅰ)光线在BC面上折射,由折射定律有
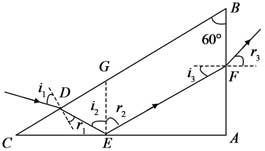
sini1=nsinr1sini1=nsinr1①
式中,n为棱镜的折射率,i1和r1分别是该光线在BC面上的入射角和折射角。光线在AC面上发生全反射,由反射定律有
i2=r2②
式中i2和r2分别是该光线在AC面上的入射角和反射角。光线在AB面上发生折射,由折射定律有
nsini3=sinr3nsini3=sinr3③
式中i3和r3分别是该光线在AB面上的入射角和折射角。由几何关系得
i2=r2=60°,r1=i3=30°④
F点的出射光相对于D点的入射光的偏角为
δ=(r1–i1)+(180°–i2–r2)+(r3–i3)⑤
由①②③④⑤式得
δ=60°⑥
(ⅱ)光线在AC面上发生全反射,光线在AB面上不发生全反射,有
nsini2≥nsinC>nsini3nsini2≥nsinC>nsini3⑦
式中C是全反射临界角,满足
nsinC=1nsinC=1⑧
由④⑦⑧式知,棱镜的折射率n的取值范围应为
23√3≤n≤2233≤n≤2⑨
[点评]:【】:
本题考查了几何光学,处理此类题的方法一般是正确画光路图利用几何关系求偏角,还要知道全发射的条件是什么。
【37题】
[答案]: (1)(2)哑铃(纺锤)
(3)H2S
(4)S8相对分子质量大,分子间范德华力强
(5)平面三角
(6)2
(7)sp3
(8)4MNAa3×10214MNAa3×1021
(9)2√2a22a
[解析]: (1)基态Fe原子的核外电子排布式为1s22s22p63s23p63d64s2,则其价层电子的电子排布图(轨道表达式)为
(3)S8、二氧化硫形成的晶体均是分子晶体,由于S8相对分子质量大,分子间范德华力强,所以其熔点和沸点要比二氧化硫的熔点和沸点高很多;
(4)气态三氧化硫以单分子形式存在,根据(2)中分析可知中心原子含有的价层电子对数是3,且不存在孤对电子,所以其分子的立体构型为平面三角形。分子中存在氧硫双键,因此其中共价键的类型有2种,即σ键、π键;固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子形成4个共价键,因此其杂化轨道类型为sp3。
(5)根据晶胞结构可知含有铁原子的个数是12×1/4+1=4,硫原子个数是8×1/8+6×1/2=4,晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,则其晶体密度的计算表达式为ρ=mV=4MNA(a×10−7)3g/cm3=4MNAa3×1021g/cm3ρ=mV=4MNA(a×10−7)3g/cm3=4MNAa3×1021g/cm3;晶胞中Fe2+位于S2−2S22−所形成的正八面体的体心,该正八面体的边长是面对角线的一半,则为2√2a22anm。
[点评]:【分析】
(1)根据铁、硫的核外电子排布式解答;
(2)根据价层电子对互斥理论分析;
(3)根据影响分子晶体熔沸点高低的是分子间范德华力判断;
(4)根据价层电子对互斥理论分析;
(5)根据晶胞结构、结合密度表达式计算。
【教育】
本题主要是考查核外电子排布、杂化轨道、空间构型、晶体熔沸点比较以及晶胞结构判断与计算等,难度中等。其中杂化形式的判断是难点,由价层电子特征判断分子立体构型时需注意:价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。①当中心原子无孤电子对时,两者的构型一致;②当中心原子有孤电子对时,两者的构型不一致;价层电子对互斥模型能推测分子的几何构型,但不能解释分子的成键情况,杂化轨道理论能解释分子的成键情况,但不能推测分子的几何构型。两者相结合,具有的互补性,可达到处理问题简便、迅速、的效果。
【38题】
[答案]: (1)C6H12O6
(2)羟基
(3)取代反应
(4)
(6)9
(7)[解析]: (1)葡萄糖的分子式为C6H12O6。
(2)葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,因此A中含有的官能团的名称为羟基。
(3)由B到C发生酯化反应,反应类型为取代反应。
(4)根据B的结构简式可知C的结构简式为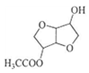
[点评]:【分析】
葡萄糖在催化剂作用下与氢气发生醛基的加成反应生成A,A在浓硫酸的作用下发生分子内脱水反应生成B,B与乙酸发生酯化反应生成C,根据C与D的分子式可知C生成D是C分子中另一个羟基与硝酸发生酯化反应,D在氢氧化钠溶液中水解生成E,据此解答。
【教育】
高考化学试题中对有机化学基础的考查题型比较固定,通常是以生产、生活的陌生有机物的合成工艺流程为载体考查有机化学的知识,涉及常见有机物官能团的结构、性质及相互转化关系,涉及有机物结构简式的确定、反应类型的判断、化学方程式的书写、同分异构体的识别和书写等知识的考查。它要求学生能够通过题给情境中适当迁移,运用所学知识分析、解决实际问题,这高考有机化学复习备考的方向。本题的难点是同分异构体数目判断,同分异构体类型通常有:碳链异构、官能团异构、位置异构等,有时还存在空间异构,要充分利用题目提供的信息来书写符合题意的同分异构体。对于二元取代物同分异构体的数目判断,可固定一个取代基的位置,再移动另一取代基的位置以确定同分异构体的数目,本题就是采用这种方法。
【39题】
[答案]: (1). 可以
(2). 在达到消毒目的的同时,营养物质损失较少
(3). 破坏DNA结构;消毒液
(4). 氯气
(5). 未将锅内冷空气排尽
[解析]: 由题意“通过消毒和灭菌来避免杂菌的污染”可知,本题考查的是“无菌技术”。理清实验室和日常生产、生活中常用的消毒和灭菌方法是解答此题的关键。
【详解】
(1)能耐高温的、需要保持干燥的物品,如玻璃器皿(吸管、培养皿)和金属用具等可以放入干热灭菌箱中进行干热灭菌。
(2)煮沸消毒法即在100℃煮沸5~6 min可以杀死微生物细胞和一部分芽孢;巴氏消毒法即在70~75℃煮30 min或在80℃煮15min,可以杀死微生物,并且增加营养物质不被破坏。因此,与煮沸消毒法相比,牛奶消毒常采用的巴氏消毒法或高温瞬时消毒法的优点是在达到消毒目的的同时,营养物质损失较少。
(3)因紫外线能破坏DNA结构,所以密闭空间内的空气可采用紫外线照射消毒。在照射前,适量喷洒消毒液,可强化消毒效果。
(4)通常乙醇消毒是75%的酒精,有气味,影响水质,不适宜消毒自来水;高锰酸钾本身有颜色,消毒后溶液呈紫红色,无法使用;因此水厂供应的自来水通常是经过氯气消毒的。
(5)采用高压蒸汽灭菌时,锅内的水加热煮沸,将其中原有的冷空气彻底排除后才能将锅密闭。如果未将锅内冷空气排尽,则会出现压力达到设定要求,而锅内并没有达到相应温度的现象。
[点评]:【】
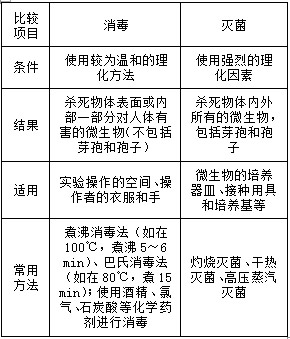
(1)消毒与灭菌的区别:
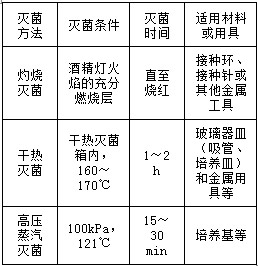
(2)三种常用灭菌方法的比较:
【40题】
[答案]: (1). E1和E4;甲的完整;甲与载体正确连接
(2). 转录;翻译
(3). 细胞核;去核卵母细胞
(4). 核DNA
[解析]: 本题以图文结合的形式综合考查学生对基因工程、核移植等相关知识的识记和理解能力。解答本题需熟记并理解核移植技术的过程、基因工程的基本操作程序,特别是明确PCR技术的原理和过程、基因表达载体的组成及其作用、限制酶的作用等相关知识并形成清晰的知识网络。在此基础上,结合问题情境,从题图中提取有效信息进行相关问题的解答。
【详解】
(1)要增加目的基因在受体细胞中能够正确表达,目的基因的首端应有启动子,尾端应有终止子。甲是将某种病毒的外壳蛋白(L1)基因连接在GFP基因的5ˊ末端而获得的L1-GFP融合基因,据此结合题意并分析图示可知:该团队在将甲插入质粒P0时,如果用E2或E3,则目的基因不完整,而使用E1和E4这两种限制酶进行酶切增加了甲的完整,而且也增加了甲与载体正确连接,因此,使用的两种限制酶,是E1和E4。
(2)构建的真核表达载体P1中含有GFP基因,而GFP基因的表达产物“某种荧光蛋白(GFP)”在紫外光或蓝光激发下会发出绿色荧光。若在导入P1的牛皮肤细胞中观察到了绿色荧光,则说明L1基因在牛的皮肤细胞中完成了表达。基因的表达过程包括转录和翻译。
(3)若要获得含有甲的牛,可采用核移植技术,即将能够产生绿色荧光细胞的细胞核移入牛的去核卵母细胞中获得重组细胞,并将该重组细胞在体外培养成重组胚胎,再经过胚胎移植等获得含有甲的牛。
(4)PCR是多聚酶链式反应的缩写,是一种在生物体外复制特定DNA片断的核酸合成技术。若利用PCR方法检测甲是否存在于克隆牛的不同组织细胞中,则应分别以该牛不同组织细胞中的核DNA作为PCR模板。
[点评]:【】
本题的难点在于对(1)的解答。解题的关键是:以题意“获得L1-GFP融合基因(简称为甲)”的过程为切入点,围绕“基因表达载体的组成及其作用”和图示呈现的“酶切位点的”信息进行综合分析。
以上就是伊顿教育网小编为大家整理的2018年卷2的理科综合试题,2019年的理科考生作为参考,希望大家在考场上考出好成绩!加油吧!